par Audrey Vaugrente
Essai clinique sauvageRepérer les mauvaises pratiques
Informée de la tenue d’un essai clinique sauvage, l’Agence nationale de sécurité du médicament (ANSM) s’est fendue de deux rappels à l’ordre contre ses organisateurs, Jean-Bernard Fourtillan et Henri Joyeux. L’organisation de ce type de recherche est très réglementée. Il est donc possible de repérer les mauvaises pratiques.
Du lieu où s’est tenu l’essai clinique au produit testé : tout s’est déroulé dans la plus totale illégalité. Ces 19 et 27 septembre, l’Agence nationale de sécurité sanitaire (ANSM) a signé deux décisions à l’encontre du fonds de dotation Josefa et Jean-Bernard Fourtillan. Épaulé d’Henri Joyeux, codirigeant de ce fonds privé créé pour l’occasion, l’ancien pharmacologue a organisé une expérience hors cadre. Des patches encore à l’état expérimental ont été testés sur des volontaires. Ils contiendraient deux hormones apparentées à la mélatonine. Baptisées valentonine et 6-méthoxy-harmalan, elles seraient impliquées dans la régulation du sommeil.
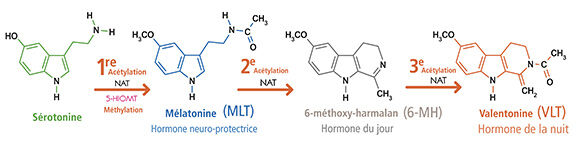
Les apprentis chercheurs ne se sont pas contentés de cette fausse promesse : les tests ont été menés sur des personnes atteintes de la maladie d’Alzheimer ou de Parkinson, en vue d’une amélioration. L’expérience est désormais interdite, tout comme la distribution des patches. Une plainte a été déposée par l’Ordre des médecins et une enquête juridique est en cours. Car si le dispositif n’en portait pas le nom, il comportait tous les signes d’un essai clinique. Or, l’organisation et la participation à de telles recherches sont strictement encadrées, afin de protéger les volontaires.
À quoi correspond un essai clinique ?
Les recherches sur la personne humaine peuvent recruter des individus en bonne santé, pour évaluer l’innocuité d’un médicament par exemple, ou malades, pour estimer son efficacité. Dans tous les cas, elles doivent être approuvées par un comité de protection des personnes (CPP), la Commission nationale de l’informatique et des libertés (Cnil), puis déclarées auprès de l’ANSM. Cela est valable même si elles n’évaluent pas un médicament.
L’expérimentation dirigée par le fonds Josefa ne remplit aucun de ces critères. Et pour cause ! Pour Henri Joyeux, il s’agissait simplement d’un test en vue d’une « preuve de concept ». Ces démarches n’auraient donc pas été nécessaires. Pour Jean-Bernard Fourtillan, l’essai était légal, puisque les patches « ne sont pas, pour l’instant, des médicaments ». En réalité, il s’agissait bel et bien d’un essai clinique de phase I. Le fait qu’il s’agisse d’hormones ne constitue en rien une exception : la mélatonine et la lévothyroxine, d’autres hormones, sont strictement contrôlées et se sont pliées au cadre.
Comment les participants sont recrutés
C’est souvent le médecin spécialiste qui propose au patient d’intégrer un essai clinique. Si toutefois vous entendez parler d’un projet de recherche qui vous intéresse, il est conseillé d’en parler à votre médecin traitant ou spécialisé dans la maladie en question. Au fait de votre historique médical, il saura vous conseiller au mieux. De nombreux essais demandent d’ailleurs aux volontaires d’être référés par un professionnel.
Différents registres recensent les essais cliniques qui ont été déclarés (1), et précisent lesquels recrutent. Pour plus de simplicité, il est possible de se tourner vers les associations de patients. De manière ponctuelle, des campagnes de recrutement sont diffusées dans les locaux des universités ou des hôpitaux, dans les journaux, par message radio ou sur les réseaux sociaux. Leur contenu doit d’abord être validé par un comité de protection des personnes (CPP).
Les Prs Fourtillan et Joyeux, qui ne sont plus en exercice, ont proposé un essai clinique directement via leur fonds de dotation sans en informer les autorités. Voilà qui sort largement du cadre légal.
Un échange très codifié
Au moment du recrutement, le médecin « investigateur » doit être clair avec la personne qu’il souhaite recruter. Son rôle est de présenter l’objectif de l’étude, ses bénéfices attendus, mais aussi ses contraintes et ses risques. Le volontaire est libre de retirer son consentement à tout moment au cours de l’essai, et doit en être informé. Parmi les éléments importants à connaître à ce stade figurent aussi l’existence d’une alternative médicale, les modalités de prise en charge au terme de l’étude ou encore la manière dont les frais seront couverts. Au terme de l’échange, l’accord de chaque participant est recueilli.
Le protocole développé par les Prs Fourtillan et Joyeux pose problème. Des patients souffrant de maladies incurables se sont vus proposer une piste d’amélioration de leur état, opposée à un vide thérapeutique. Difficile, dans ces conditions, de parler de consentement éclairé.
Où sont menés les essais cliniques ?
Le lieu même de tenue des essais cliniques est réglementé. Il doit disposer des moyens humains, techniques et matériels appropriés à la recherche, tout en permettant de garantir de respecter des impératifs de sécurité. S’il ne s’agit pas d’un lieu de soin, ou si le lieu de soin accueille des activités sortant de son exercice habituel, l’autorisation sera limitée dans le temps. Nous sommes donc loin du cadre d’une abbaye, comme celle où s’est déroulée l’essai clinique proposé par les Prs Fourtillan et Joyeux…

Faut-il payer ?
En France, la loi est claire. Le promoteur de l’essai clinique – c’est-à-dire celui qui l’organise – est en charge de ce volet. Au moment où l’essai clinique se déroule, son financement est déjà acquis. Demander aux volontaires d’avancer la somme, comme l’ont fait Henri Joyeux et Jean-Bernard Fourtillan, n’est donc pas légal. C’est un signe d’alerte absolu, de même que des incohérences dans les déclarations (dates de dépôts de dossiers, par exemple) et la présence de fautes d’orthographe dans les documents.
Comment trouver un essai de qualité
La légalité d’une recherche ne fait pas tout. Encore faut-il qu’elle fasse utilement avancer la médecine ou la science. Pour cela, plusieurs points peuvent être d’importance lors de l’échange préliminaire. Qui finance l’essai ? S’il s’agit d’une structure ayant intérêt à ce que les résultats soient positifs, prudence. Vous pouvez alors demander aux médecins qui mènent les recherches s’ils sont payés par ce financeur, ou si ce dernier est impliqué dans l’élaboration de l’étude. Si la réponse est oui, ses résultats risquent d’être moins fiables. Enfin, quelle est la nature de l’essai ? Si le produit n’est pas comparé à un placebo ou un traitement actif, les résultats seront moins solides.
Les principales questions à se poser avant de participer à un essai clinique
- Quel est le but de cette recherche ?
- Le produit sera-t-il comparé à un placebo ?
- Comment le traitement sera-t-il administré ?
- Quel sera le suivi au cours de l’étude et après sa fin ?
- Faut-il participer financièrement ?
- Serai-je indemnisé ? Mes frais seront-ils remboursés ?
- Comment serai-je informé des résultats ?
- Qui finance l’essai ?
- L’investigateur a-t-il des intérêts financiers ?
Audrey Vaugrente
Lire aussi